近日,中国科学院自动化研究所脑网络组与脑机接口北京市重点实验室蒋田仔团队,在《自然·通讯》(Nature Communications)期刊发表研究论文,基于最优传输框架提出了一种解析脑网络通讯的新方法——CLRIA(Connectome-constrained Ligand-Receptor Interaction Analysis)。最优传输是一种数学方法,旨在找到将一个分布转换为另一个分布所需的最小成本方案。研究团队将这一理论应用于脑网络分析,以不同脑区中配体和受体的表达水平作为分布,并以神经纤维连接作为约束条件,成功整合了大脑结构连接数据和基因表达信息。通过这一方法,研究人员构建出由“配体-受体”介导的脑区通讯模式,揭示了连接结构与信号分子的内在联系,为理解脑网络通讯提供了微观视角。
在脑网络中,神经纤维束可延伸至不同脑区,为脑网络的高效通讯提供物质支持。为了建模连接结构和信号分子的耦合机制,需要基于连接组的通讯度量来引导跨脑区配体-受体相互作用,从而克服使用空间距离约束的弊端,实现对组织中固有信号通路和形态组织的更深刻理解。
该研究提出的CLRIA方法将配体和受体在各个脑区的表达视为两组分布,将脑中的通讯过程建模为多个“配体-受体”对共同参与的最优传输问题,并引入基于连接组的通讯度量作为转运成本约束,进一步利用非负张量分解技术对转运计划引入低秩约束,由此实现了对大脑网络通讯模式的高效推断。研究团队通过整合分析人类连接组计划数据(HCP)和艾伦人脑图谱(AHBA)数据,发现大脑在信号传递中倾向于采用混合通讯策略,即路由(Routing)和扩散(diffusion)通讯策略同时存在,以平衡能量效率与信息传输需求。并表现出从低级感知区域向高级联合皮层的方向偏好。这一结果,揭示了微观尺度的配体-受体相互作用与宏观尺度功能组织之间的广泛联系。
研究通过连接组谱密度分析,还发现了一组与低频谐波模式密切相关的配体-受体基因。这些基因在儿童至青少年阶段不同模态脑区之间的表达差异显著,表明其可能在大脑发育过程中发挥重要作用。此外,研究发现,CLRIA方法识别出的通讯模式不仅能鉴定出脑状态转换过程中的关键脑区,还能有效解码这一过程中的关键信号分子。
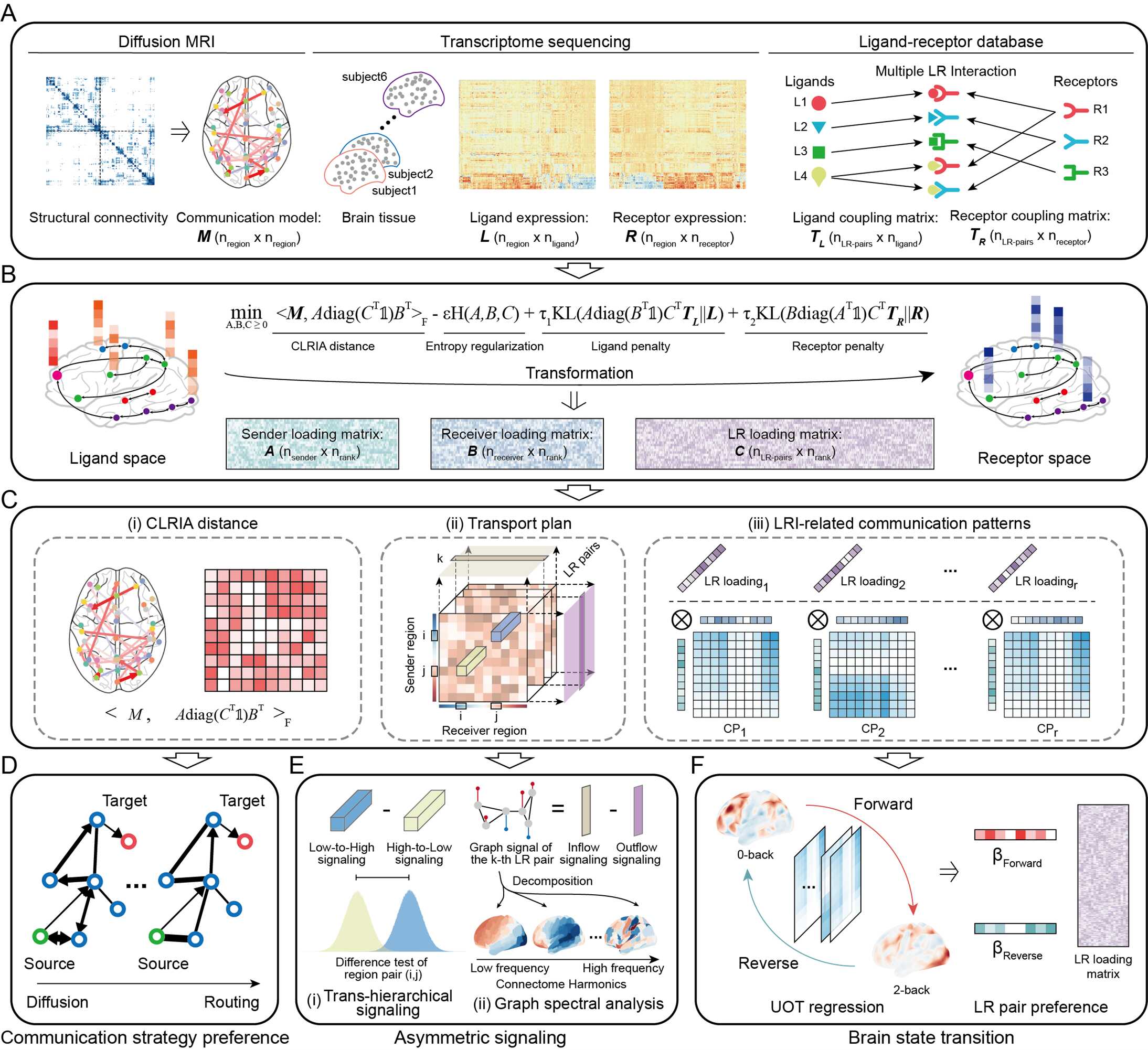
CLRIA方法与下游分析概述
该研究在全脑尺度上实现了结构连接与分子表达的跨尺度融合,为理解脑网络通讯提供了新的计算框架和生物学见解。CLRIA方法具有较高的通用性,可拓展至病理标志物、代谢组数据等多模态分析中,为精神疾病、神经退行性疾病的机制研究提供新思路。
中国科学院人工智能学院的博士生杜宗昌为该论文第一作者,中国科学院自动化研究所蒋田仔研究员和杨正宜副研究员为共同通讯作者。论文的主要合作者包括初从颖副研究员,时维阳助理研究员,罗娜副研究员。该研究获科技创新2030——“脑科学与类脑研究”重大项目、国家自然科学基金和中国博士后科学基金等项目支持。